



我们的大脑如何在无数纷繁复杂的信号中抽丝剥茧,精准地协调并控制身体的每一个动作?其中大脑皮层-基底神经节神经环路起了决定性的作用,而皮层究竟是如何调控基底神经节中不同通路则知之甚少。2025年10月21日,av影片 金鑫教授团队在国际综合期刊《eLife》在线发表研究论文“Asymmetric cortical projections to striatal direct and indirect pathways distinctly control actions”,该研究揭示了皮层神经元到纹状体直接通路(D1)和间接通路(D2)之间存在非对称的并行连接模式。这一发现不仅深化了我们对大脑运动控制机制的理解,也为阐明脑内信息整合的基本原则提供了新视角,更为帕金森病等运动障碍性疾病的干预治疗带来了新的启示。

▲ av影片 金鑫教授研究团队在eLife上发表研究成果
动物的每一个动作——从简单的伸展到复杂的动作序列——都依赖于大脑组织运动的能力。基底神经节是这套运动控制机制的核心,这群脑内的皮层下核团通过整合皮层信号来引导动物的行为。在基底神经节内部,纹状体中表达D1和D2多巴胺受体的多棘投射神经元(SPNs)形成了两条主要通路——即所谓的“直接通路”和“间接通路”。过去的大量研究表明上述两条通路分别促进和抑制/切换运动,形成精妙的平衡以实现灵活适应性的行为。与此同时,作为基底神经节的信息输入来源,每一个皮层脑区都会各自向对应的纹状体区域发送兴奋性投射,而在纹状体中D1和D2型SPNs是混合均匀分布的。那么,作为大脑皮层如何与这两条通路实时通信以协调行为?这一问题仍然是神经科学领域长期存在的一个谜团。它们是由同一批皮层神经元同时驱动?还是由不同的皮层神经元分别驱动?亦或是同时驱动但皮层神经元有一定的偏向性?
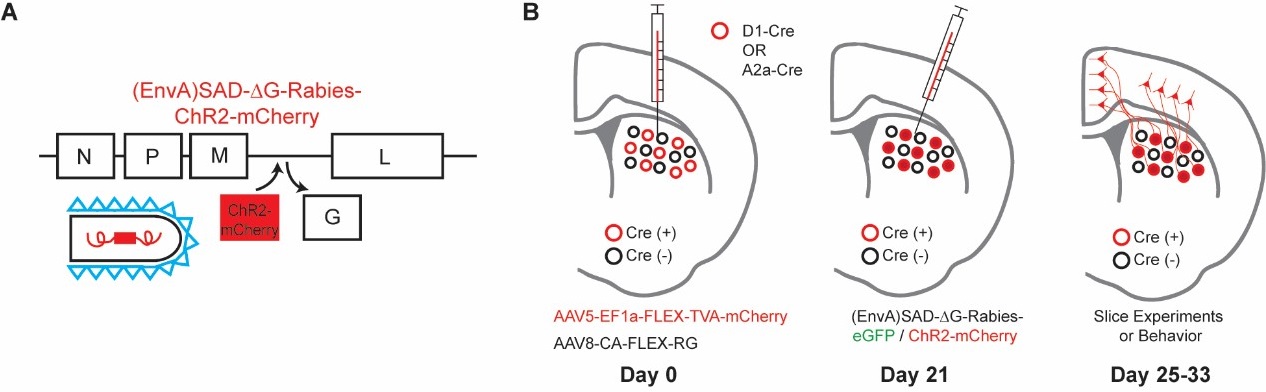
在这项新的研究中,研究人员使用最新的逆行跨突触病毒追踪技术结合光遗传学技术,绘制了投射至D1/D2-SPNs的皮层神经元连接概率图谱,并探究了这些不同输入模式如何影响行为。该团队采用G蛋白缺失的狂犬病毒系统来表达光敏感蛋白ChR2,选择性标记了与各SPN亚型相连的突触前皮层神经元,通过电生理记录功能性突触连接的方式发现了一种不对称的连接分布:虽然仅约三分之一投射至D1-SPN的皮层神经元会同时连接D2-SPN,但超过三分之二连接D2-SPN的皮层神经元也会与D1-SPN建立连接。这些研究结果表明,投射向直接通路的皮层神经元更倾向于主要驱动直接通路,而间接通路所接收的皮层输入则更倾向于同时驱动两条通路。因此,皮层的输入得以通过这种并行且不对称的模式来调控基底神经节和协调运动。研究人员进一步通过光遗传学技术选择性激活活体动物中投射至D1或D2-SPN的初级运动皮层(M1)或中部扣带皮层(MCC)神经元在行为上验证了这些功能。
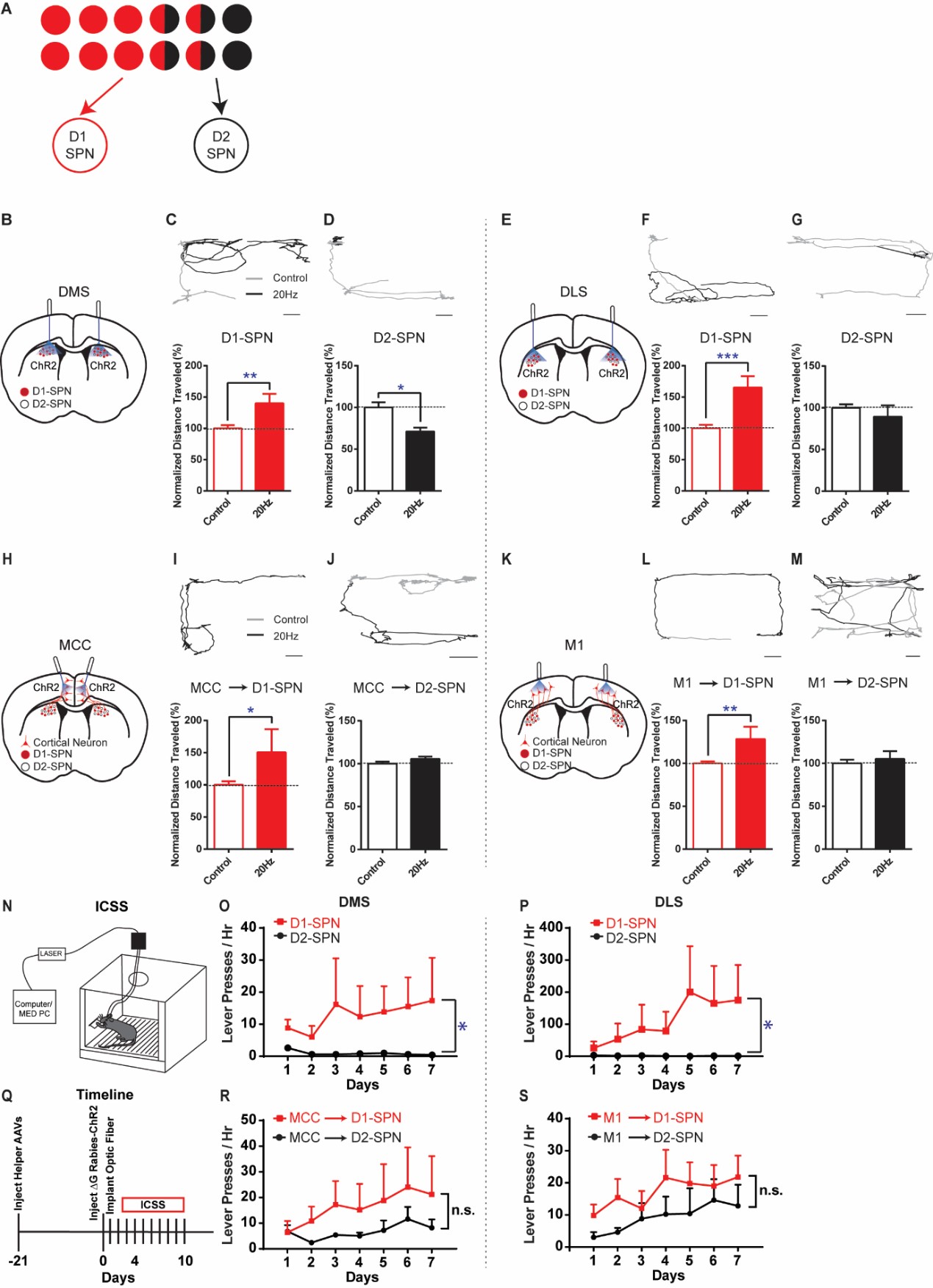
这些结果共同揭示了皮层-纹状体网络的组织方式:大脑运动皮层通过不对称重叠的通路与基底神经节通信,共同实现精准灵活的运动控制。该发现或有助于解释皮层指令如何转化为协调动作,以及该神经环路紊乱在帕金森病、自闭症和强迫症等神经精神疾病的运动异常中扮演了何种角色。
av影片 科研助理严循一为论文的共同第一作者,金鑫教授为唯一通讯作者。研究获得新基石研究基金等多项资助支持。
附: